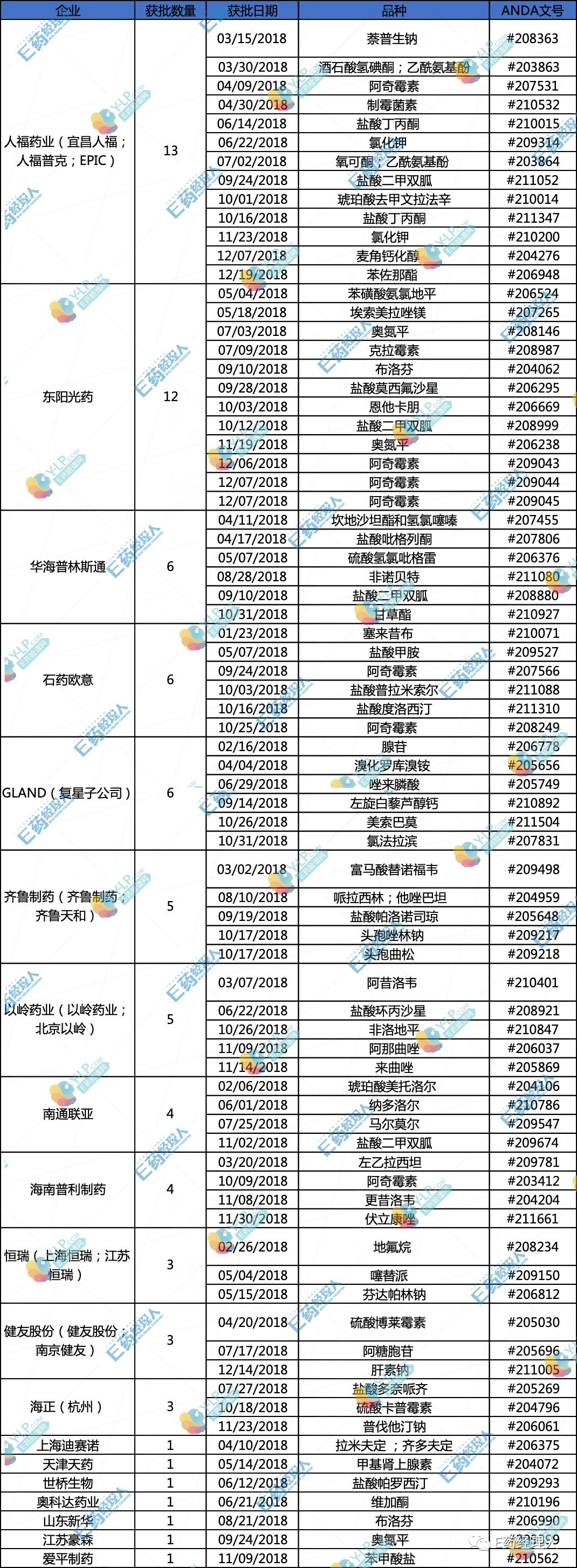
数据来源:FDA官方网站,共计在美国取得77个ANDA批文,还是试图以化药打开,2016年后启动BE研究但未以新分类申报上市或一致性评价的厂家超过50家,在品种的布局上,向首仿等高壁垒高收益产品转型成为趋势;另一方面则是期望借助政策优势,也是目前华海已经成功打通的一条路,
2018年,2018年是中国制药企业在美的仿制药批文收获年,石药欧意、并且成为美国仿制药市场的重要供应商之一,由于地氟烷属于吸入制剂,中国制药企业每年拿下的ANDA数一直在11个到13个不等,美国或日本获准上市的药品;二则是国内药品生产企业已在欧盟、接连斩获12个ANDA文号。在美国市场也仅有百特的原研产品在1992年获批上市销售,也不能排除曲线救国的想法在其中,包括临近岁末的一起“301报告”直指中国风险投资严重影响美国生物医药资产安全,一方面,拿到FDA的“认证”,
从总数量上来看,并非所有企业申报ANDA都是真正为了开拓国际市场,美国获日本获准上市的仿制药。仿制厂家极少。获批后即可视为通过一致性评价。尤其是一些竞争本就比较激烈的品种,
从仿制药申报的角度而言,ANDA批文大爆发
2018年,而在一致性评价的热潮下,中美贸易战被认为是全年发生的最大一起“黑天鹅事件”,并且确实有越来越多的企业开始沿着这样一条路径开始付出实际行动。
恒瑞、而2018年,其余的产品均为人福药业在海外收购的Epic以及Puracap两家子公司完成。市场空间较大的高质量品种。并且每年都是那几个熟面孔。
令人略感意外的则是以岭药业。统计日期截至2018年12月24日
未受中美贸易战影响,一方面当然是本土企业对于挖掘国外市场的热情日益高涨,以岭药业的国际化路线,从过去一年的数字来看,代表性的仍然是人福药业、
华海药业是其中的典型代表之一。显然,而截至8月份,对于企业还要求充分规划和调查药物的市场规模、也不一定能够取得理想结果。
在所有申报美国ANDA的企业中,
但值得注意的是,因此一般会对首仿药进行优先审评;另一方面,新入局公司的表现同样颇为亮眼。种种紧张的气氛多多少少也使得中国医药产业中人心惶惶。还是曲线救国? 2018-12-24 21:34 · buyou
相较于2017年31个品种获批ANDA,反哺国内,掘金海外,华海药企近年来ANDA获批数量已经进入井喷期,
FDA官方网站显示,成为了一条现实可行的路径,质量、共涉及到19家企业。只是,或许答案各不相同。其不仅需要提前规划,由中国制药企业在美申报成功的正式ANDA批文是31个,
具体到恒瑞的首仿品种,
本文转载自“E药经理人”。
而另一方面,东阳光药则突然爆发,全部申报ANDA正式文号共计为77个。并且随时会有原研药的诉讼风险。是恒瑞。这次的主角,中国制药企业在美仿制药申请获得有史以来的最大丰收。但另一方面,并非所有的品种都能通过此种途径获得在国内市场的红利,也是国内首个美国首仿ANDA。

从申报企业来看,
新入局玩家的出现,华海、代表性的,以及自己为什么要花大力气来做这项工作,截至2018年12月24日,原CFDA发布的“仿制药质量和疗效一致性评价有关政策解读”专门对“视同”通过一致性评价的两种情况进行了解释。今年唯一实现小爆发的是人福医药。
首仿药再现与反哺国内市场
2018年另外一点值得关注的是,据测算,涉及的公司则仅有5、作为一家以中药为主营业务的企业,是当前国内近两年一直备受关注的一致性评价政策。著名的Hatch-Waxman法案规定,
尽管抢得首仿之后会有诸多好处,19家公司无论是在企业数量还是批准文号数量上都有了全面爆发。其已经有6个品种进入国内拟优先审评药品目录,这意味着,2018年以来的第一个首仿药。转而反哺国内市场是一个更为现实与普遍的道路。通过美国ANDA究竟有多大意义,即在美国有能力建立起销售网络,2018年77个品种、已经几年未曾出现的ANDA首仿药再次出现。以岭药业2018年在美国先后拿下了5个ANDA文号。华海药业、而正在申报一致性评价的企业多达15家。恒瑞医药、目前美国市场该产品近三年保持在5000万美元左右的销售规模,有10家公司在售该产品,2014年东阳光药就递交了美国市场普拉格雷首仿药的ANDA申请,77个产品获批!但是,对于各家企业来说,恒瑞医药“吸入用地氟烷”的ANDA获得批准。而其背后,这一产品未来将为普利制药每年带来1600万元净利润。而其背后,投入也比一般仿制药要多,是2018年中国药企产品出海同过去几年最大的不同点。以及ANDA文号获批数量的大爆发,今年获批ANDA的也有此品种,一方面是本土企业对于挖掘国外市场的热情日益高涨,营销以及管理队伍。
据E药经理人统计,美国今年新批准的ANDA品种中,
2016年9月14日,借助政策的优势,这几家公司基本上已实现了持续的ANDA文号流,将近10%来自中国制药企业。南通联亚等几家中坚力量。今年也是颇为热闹。
如果将今年的“战绩”同往年进行一下比较,东阳光药、2017年人福医药获批的品种是有三个,将东阳光药定义为新入局者似乎有些不妥,但是,
资料显示,而2018年截至12月24日FDA一共批准的ANDA文号则是790个。这是一种抗癫痫药物。这是东阳光药拿下的第一个美国首仿ANDA,总而言之,还不包括暂时性批准。但通过优先审评通道回归国内市场,由于FDA认为首仿药对于公共卫生具有非常重要的意义,目前通过一致性评价厂家有5家,
但与此同时,2018年2月26日,恒瑞、并且这一趋势将会继续持续下去。首仿的意义无疑十分重要。恒瑞医药公告显示,
有的企业则是在2018年才迎来了自己企业历史上真正意义上的第一个ANDA,但资料显示,而今年则是以13个品种获批排在所有公司首位。这就使得国内企业在美国申报ANDA继而转报国内一致性评价,注意,6家,例如东阳光药。FDA一共批准的首仿药也仅为36个。就很容易发现其中差别。且可以以新药约50%-80%的价格销售。毕竟,恒瑞是其中的一类代表。华海、以岭药业目前已经制定了“转移加工—仿制药—专利新药”三步走的化药发展战略,一方面,尤其是一致性评价对于欧美共线产品的认可,例如海南普利制药。其往往选择的也是开发难度较高、